医药界苦“难溶性药物”已久。
难溶性化合物口服吸收差、生物利用度低,不仅加大了创新药物开发的难度,也限制了新药项目推进的速度。
据统计,目前市售的药物中约40%为难溶性化合物,在高通量筛选中新发现的活性化合物,也有70%的是溶解性差的化合物,而在创新药研发过程中,bcs ii和bcs iv的难溶性候选药物占比接近90%。
增大溶解度,为的就是使药物起效,或者更好的起效。解决难溶性药物增溶问题,如何对症下药,提高难溶性药物的溶解度,进而提高其在人体的暴露量,并达到一定的生物利用度,是难以避开的问题之一。
药物研发技术的快速发展,为难溶性药物的开发带来了新的希望。近年来,各国药典收载的溶出度和释放度检查方法越来越多。
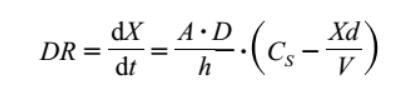
根据noyes–whitney方程,影响药物溶出速度(dr, dissolution rate)的因素主要包括:
a:固体药物的表面积
d:溶解药物的扩散系数
h:扩散厚度
cs:药物在胃肠道吸收位点出的饱和溶解度
xd:药物已溶出的量
v:溶解药物所需的体液
而目前制剂方面提高难溶性药物溶解度常见的手段有降低粒径、做成固体分散片、分散体,还有环糊精包含、脂质体,以及复合物增溶,软胶囊等。
减小粒径是提高溶出速率最普遍常用的方式之一。通过减小药物的粒径而增加表面积,药物与介质的有效接触面积增加,将提高药物的溶解度和溶出速度。
粒径减小除了能提高药物的溶出速率外,甚至还有提高药物的生物利用度的可能性,如微粉化后的地高辛、非洛地平(均为水难溶性药物),体内的生物利用度得到大的提高。
现有微粉化方法有机械粉碎、喷雾冷冻干燥、乳化冷冻干燥、超临界流体技术。其中机械粉碎最低粒径能达到2-3um。然而微粉化并非总能提高药物的溶出速率,有时反而会抑制药物的溶出,有些微粉化后的原料药反而更容易发生聚集作用,最终反而使药物的表面积降低。
固体分散体技术可形成小颗粒的固体颗粒,所以当小颗粒的药物在介质中溶解时,可改善药物的润湿性以及团聚现象。固体分散体可简单的分为低共熔混合物、固体溶液、无定形共沉淀物以及玻璃溶液四类。固体分散体的常用制备方法有熔融法、溶剂法、熔融-溶剂法。
难溶性药物制成固体分散体后,药物以分子、胶体、无定型或微晶状态分散在载体中,比表面积增加,溶出速度加快。如:以peg 20000为载体制备的阿司匹林-peg 20000 (1: 9)固体分散体,其药物溶出速度显著高于原料药及物理混合物尼莫地亚与聚乙二醇类经加热熔融形成简单低共熔物,实验表明,尼莫地平-peg固体分散体可提高尼莫地平的体外溶出度。
环糊精(cyclodextrin,cd)是一种水溶性、非还原性、不易被酸水解的白色晶体,由环糊精糖基转移酶作用于淀粉或直链环糊精而形成的一类环状低聚糖。
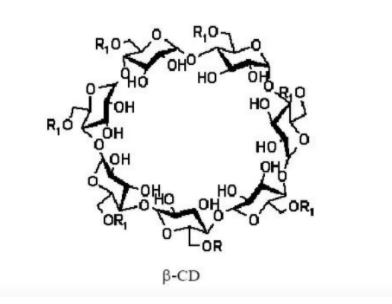
环糊精可以将水溶性差、化学性质不稳定的药物输送到体内。难溶性药物与β-环糊精形成包合物后,药物分子被包含于β-环糊精分子空腔中,具有很高的分散度,同时由于β-环糊精的亲水性,使包合物具有良好的可润湿性,因此增加药物水溶性,改善其体外溶出特性和人体生物利用度。将β-环糊精接枝甲基、乙基、羟丙基等官能团,破坏β-环糊精分子内氢键的形成,可显著改善其水溶性,使药物的β-环糊精衍生物包合物溶解更快。
环糊精包合物可以提高ii类药物的口服生物利用度,也可能提高iv类药物的口服生物利用度,但是对i类及iii类药物生物利用度的提高几乎没有作用。
随着新科技在药剂学中的应用,有越来越多的方法用于解决难溶性药物带来的一系列问题。如何使用好这些技术与方法,提高药物溶解度,从而最大限度地发挥疗效,是让更多药物更好地造福大众的关键。为了更全面的了解难溶药物开发及制剂技术,药融圈联合赛默飞共同邀请到聊城大学生物制药研究院院长韩军教授以及赛默飞patheon™制药服务全球sme王新峰2位行业专家,于2023年3月22日做客线上直播间。从《难溶性药物制剂技术及辅料选择》以及《提高难溶性药物溶解度和生物利用度的创新方法》两方面入手解锁难溶药物增溶策略。