高端复杂制剂系列:在真正的know-how面前,可以使得一款药物上市销售20~30年来,年销售额也能常年维持在10亿美元以上,即使中途专利到期了,仿制药商也很难跟随,高度复杂制剂的门槛与回报就是这么高。
任何药企都希望自己开发出来的药物属于市场空间大、竞争空间小和常年能维持高利润的品种,这样的品种乍一听似乎不应该存在这世上,但是加多一个限定词,门槛高,这样的品种就有存在的理由了,而高端复杂制剂正属于这样的品种。
本文从原研和仿制药两者间的角度,介绍下那些门槛高且常年能维持高利润空间的高端复杂制剂,并将它们分为3类,“迟仿”、“难仿”和“不能仿”,无不透露着国内此赛道的巨大投资价值。
“迟仿”,大品种的普通制剂原研专利到期后,一两年时间就会诞生许多家仿制药,使得原研销售额呈现断崖式下降,而对于高端复杂制剂,专利到期后,则需要许多年才会零星出现仿制药,且对原研销售额影响有限。
“难仿”,高端复杂制剂的专利到期许多年后,仍未出现仿制药,甚至fda资助某些机构,助力此类品种的仿制药的开发。
“不能仿”,由于中美之间的专利审查差异,原研在美国的专利仍在保护范围内,而在中国的专利已经到期,使得国内有能力的制药商更早地将高端复杂制剂开发出来,而国外原研仍在扩适应症,是一个增量市场。
盐酸多柔比星脂质体注射液
多柔比星属于蒽环类药物,蒽环类药物已成为治疗血液瘤和实体瘤的最重要药物之一。常规蒽环类药物的治疗指数相对较低,随着药物累积剂量的增加,心脏毒性的风险会增加,而且在与其他药物如曲妥珠单抗联用时也是一个问题,曲妥珠单抗本身就是一种心脏毒性药物。因而在盐酸多柔比星注射液的基础上,开发出具有靶向作用的盐酸多柔比星脂质体注射液,这里的靶向可能是基于纳米药物的erp效应。
2012年的一篇临床试验荟萃分析文章研究了2220名患者,其中1112名患者接受了脂质体蒽环类药物治疗,1108名患者接受了常规蒽环类药物治疗,表明了多柔比星脂质体具有更好的心脏安全性和更少的骨髓抑制、脱发、恶心和呕吐,在不影响疗效的情况下具有更好的治疗指数(资料1)。
比较两者的工艺开发难度,普通的注射液出现至少3家仿制药,需要2年时间,而脂质体注射液则需要8年时间。据future market insights预测(资料2),2022年全球脂质体多柔比星市场规模在12.4亿美元,2026年为15.3亿美元,2032年为21亿美元。
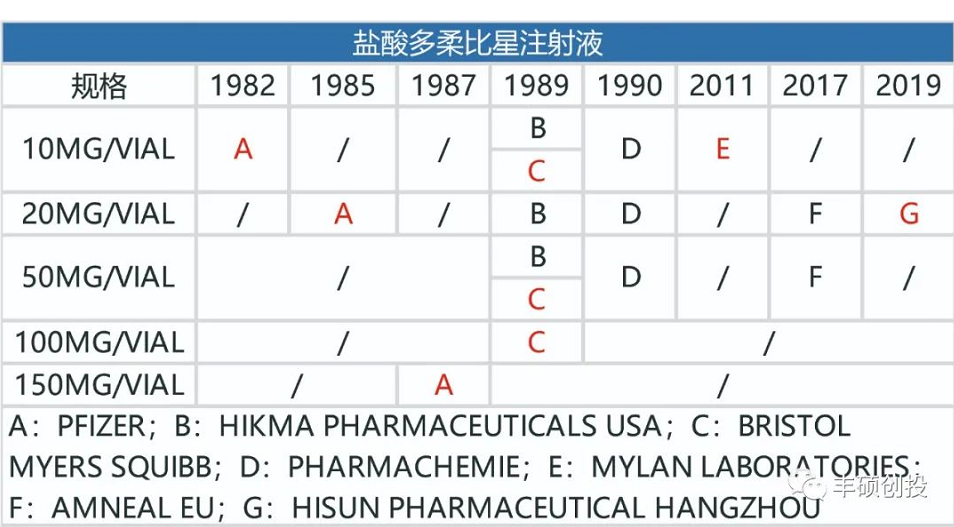
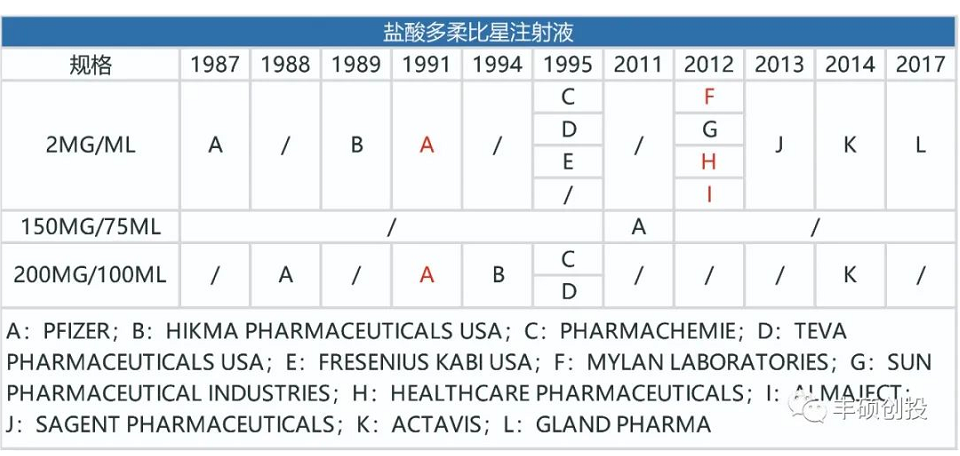
图1 fda历年来获批的盐酸多柔比星注射液品种(红色代表退市,来源:fda,丰硕创投整理)
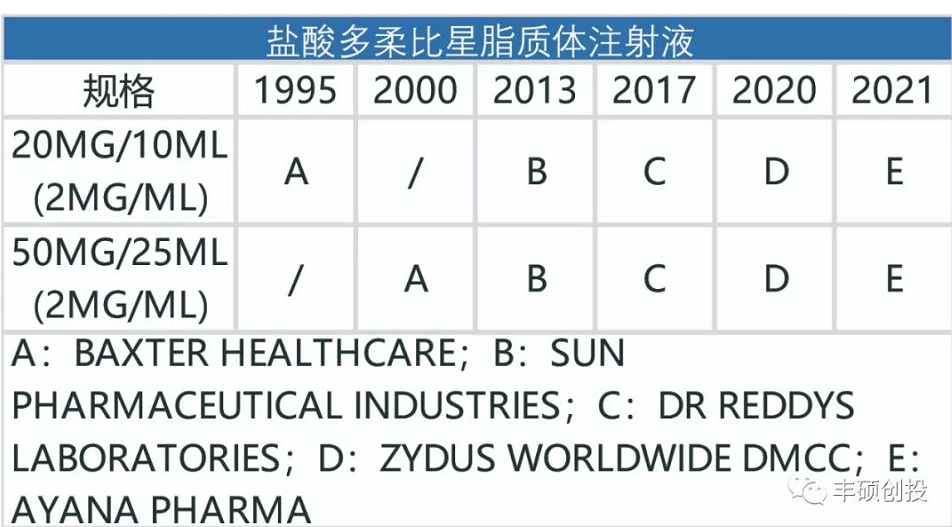
图2 fda历年来获批的盐酸多柔比星脂质体注射液品种(来源:fda,丰硕创投整理)
两性霉素b脂质体注射液
传统的两性霉素b是一种广谱抗真菌药,自1950年引入了临床实践以来,已被用作治疗许多侵袭性真菌感染的标准疗法。据2015年的一项临床试验荟萃分析显示(资料3),研究了2172名患者,与传统的两性霉素b相比,脂质体两性霉素b具有较低的肾毒性和输液反应。
商品名为ambisome的两性霉素b脂质体注射液于1997年获得美国fda批准,翻查吉利德历年来的年报,ambisome自1998年-2021年的全球销售额整体上呈上升趋势,于2021年达到5.4亿美元,按照市场划分,这款药物在美国的市场不大,常年销售额在几千万美元级别,收入贡献主要来自欧洲市场和其余市场。
这款药物在上市25年后仍未达峰,目前保持不错的增速,2022q1同比增长了19%。它的美国专利于2016年到期,直到5年后的2021年美国本土才有第一家仿制药出现。
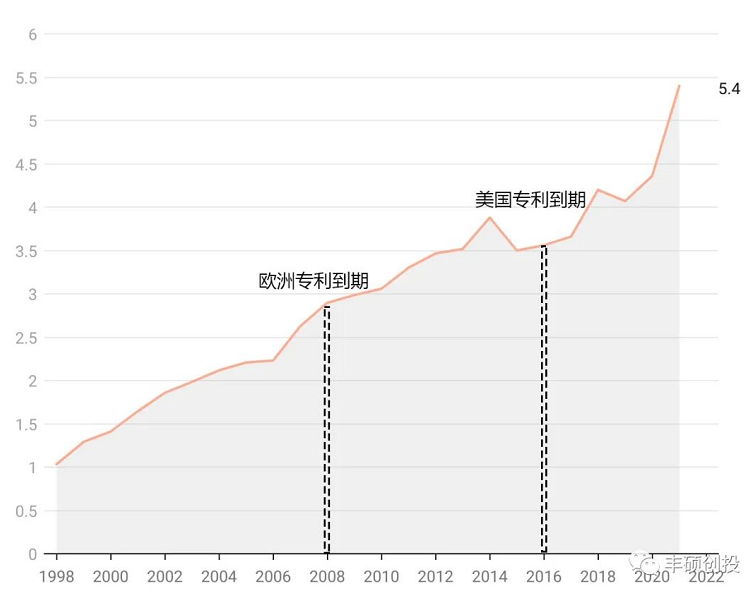
图3 ambisome历年来销售,单位亿美元(来源:吉利德年报,丰硕创投整理)
醋酸戈舍瑞林缓释植入剂
戈舍瑞林是一种促黄体激素释放激素(lhrh)的十肽类似物,通过分散在生物可降解的丙交酯/乙交酯共聚物,做成皮下植入的1月制剂和3月制剂的长效制剂,主要用于治疗乳腺癌、前列腺癌和子宫内膜异位症等。
商品名为zoladex的醋酸戈舍瑞林缓释植入剂于1989年获得美国fda批准,翻查阿斯利康历年来的年报,zoladex自2001年-2021年的全球销售额整体上略有起伏,但近些年来保持持续增长,于2021年达到9.48亿美元,按照市场划分,目前这款药物在美国的市场不大,销售额在几千万美元级别,收入贡献主要来自新兴市场。
这款药物达峰时间为2011年,峰值为11.79亿美元。在上市33年后仍能保持不错的增速,2022q1同比增长了10%,其中新兴市场增长22%,不排除未来能打破销售峰值的记录。它的欧洲专利于2010年到期,直到6年后的2016年,在中欧和东欧地区出现了第一个仿制药(资料4)。
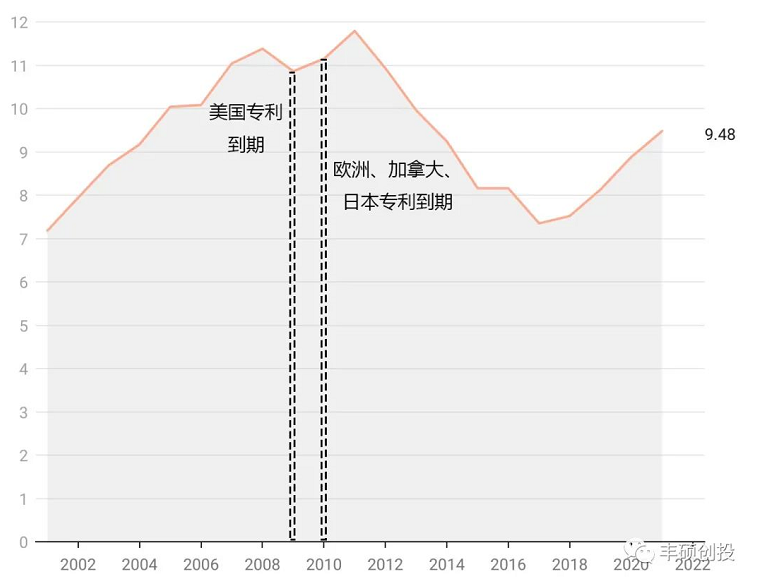
图4 zoladex历年来销售,单位亿美元(来源:阿斯利康年报,丰硕创投整理)
注射用奥曲肽微球
奥曲肽是合成环状八肽衍生物,具有与天然生长抑素相似的药理特性。初始上市的剂型为每日注射的剂型,后来通过将奥曲肽分散在生物可降解的葡萄糖星形聚合物、丙交酯/乙交酯共聚物制成的微球内,做成臀内注射的1月制剂的长效制剂,主要用于治疗肢端肥大症和胃肠胰内分泌肿瘤等。
商品名为sandostatin lar的注射用奥曲肽微球于1998年获得美国fda批准,翻查诺华历年来的年报,大体上得到以下几点,第一点是每日注射剂型的sandostatin出现前3家仿制药仅需要2年时间,1月制剂的美国地区外的专利到期时间为2010年,直到9年后的2019年欧洲地区才出现仿制药,美国地区的专利到期时间为2014年,到2022年仍未出现仿制药。
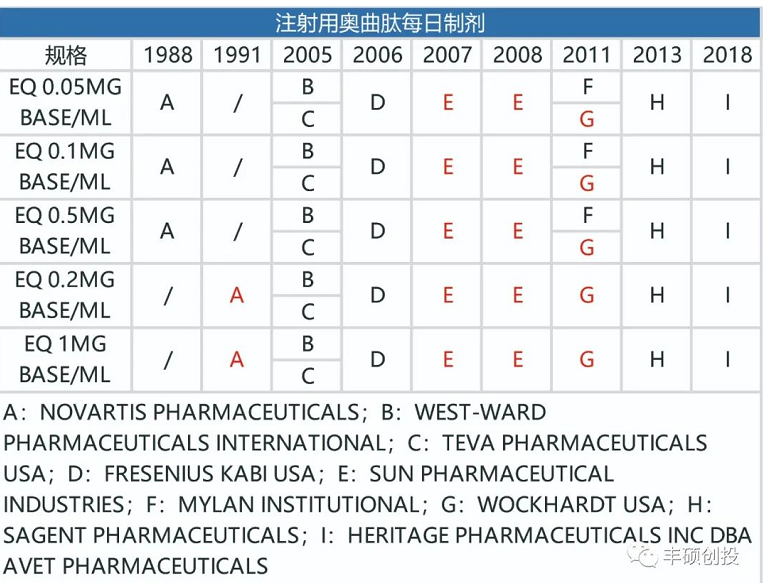
图5 fda历年来获批的注射用奥曲肽每日制剂品种(红色代表退市,来源:fda,丰硕创投整理)
第二点是每日注射的剂型自1988年上市后,卖了近20年销售额仍未突破10亿美元大关,直到1998年1月制剂的微球上市后,逐年放量,在2007年这个品种(每日 1月)终于达到了10亿美元大关,当年每日制剂已经有超过3家仿制药上市了,并在随后一两年的年报了得到证实,这个品种的销售贡献,90%来自1月制剂。所以下面的图,几乎可以认为是1月制剂sandostatin lar的销售收入。
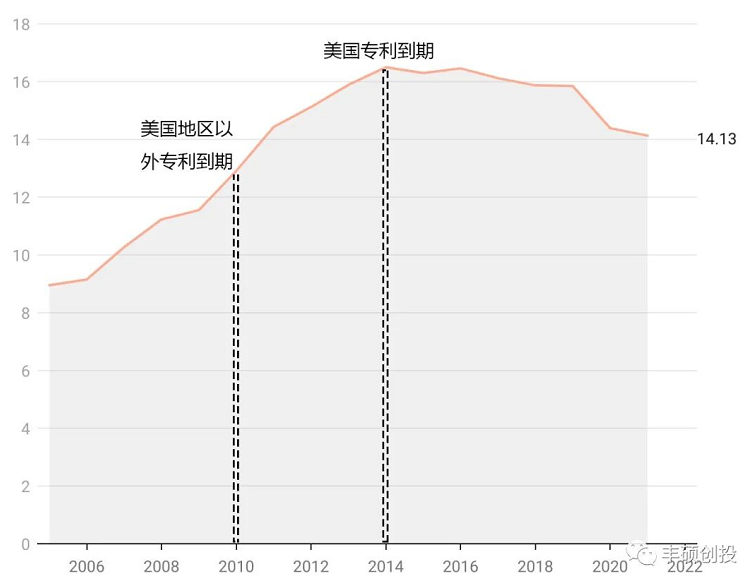
图6 sandostatin历年来销售,单位亿美元(来源:诺华年报,丰硕创投整理)
第三点是,这个品种在美国市场常年贡献一半以上的销售。
综上,对于这个品种来说,长效制剂不仅能很好地避免仿制药对普通剂型的销售蚕食,同时也能再创销售额新高,高端制剂的高技术门槛,极大地延缓后来仿制者的入局,使其常年保持在十数亿美元的销售水平。
醋酸兰瑞肽缓释注射液
兰瑞肽具有与奥曲肽相似的作用机理,都是天然生长抑素的八肽衍生物,醋酸兰瑞肽缓释注射液是一种凝胶状的1月制剂。
商品名为somatuline depot的醋酸兰瑞肽缓释注射液于2007年获得美国fda批准,翻查ipsen历年来的年报,somatuline的销售额连年递增,是一个十数亿欧元的品种,近几年受到欧洲地区奥曲肽(始于2019)和兰瑞肽(始于2021德国,德国专利2015到期)仿制药的轻微影响,导致增速放缓,主要市场集中在美国,美国地区专利2020年到期,至今尚无仿制药。
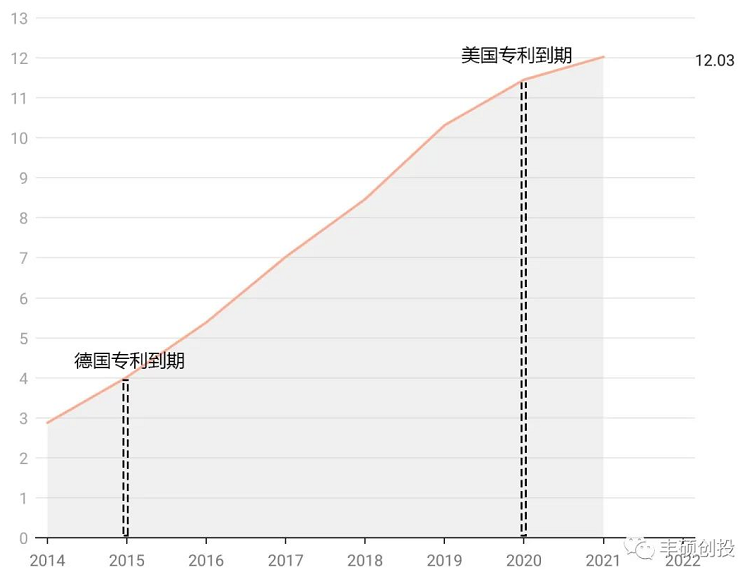
图7 somatuline depot历年来销售,单位亿欧元(来源:ipsen年报,丰硕创投整理)
注射用利培酮微球
利培酮是一种非典型抗精神病药物,刚开始的剂型为每日口服剂型,但在精神疾病里面,影响药物临床有效性的关键因素之一是依从性,后面就开发出了注射用利培酮微球(2周制剂)。
从下面3张图可以看出,制造门槛低的利培酮口服剂型,一旦专利到期,仿制药商就会蜂拥而出,口服剂型的销售额从2008年的21.26亿美元降到2009年的8.99亿美元,一年时间降幅57.71%。
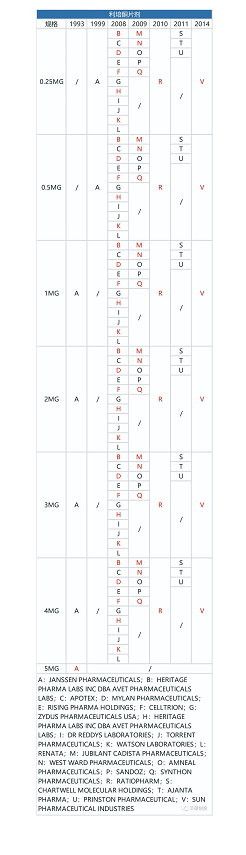
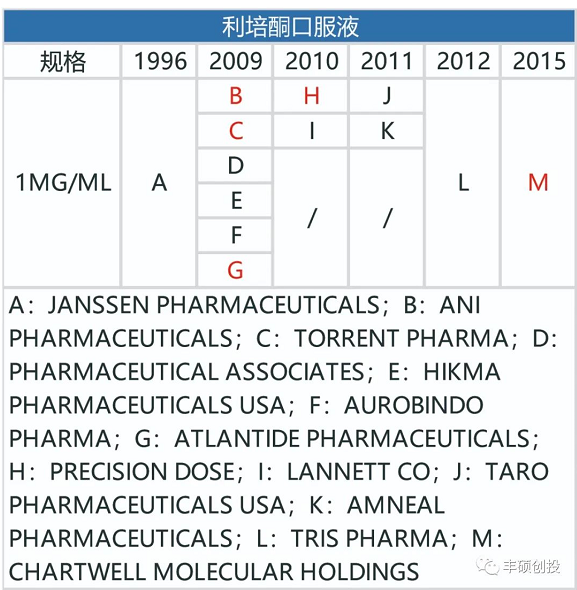
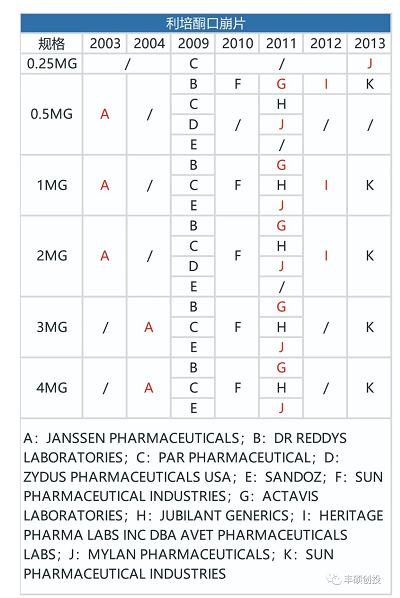
图8 fda历年来获批的利培酮口服剂型品种(红色代表退市,来源:fda,丰硕创投整理)
利培酮微球于2003年获得美国fda批准,全剂型(每日口服 长效微球)峰值在2006年达到41.83亿美元。在2009年口服利培酮专利悬崖后,利培酮微球顺利接棒,于2011年利培酮微球达到了15.83亿美元的销售峰值。后面的销售出现下滑,一方面由于便宜的口服剂型造成的剧烈竞争,另一方面由于强生公司自身的其他长效抗精神病药物帕利哌酮的强劲销售导致。至于这几种长效抗精神病药物(阿立哌唑、奥氮平、帕利哌酮、利培酮等)的临床效果比较,2017年的一项研究表明(资料5),它们之间的效果没多大差别。
所以利培酮微球仍具有相当大的临床价值,面对口服仿制药十来年的侵蚀,其2021年销售额在5.92亿美元,依旧是个不小的品种。其美国专利最晚于2020年到期,目前仍未出现仿制药,和人从众的口服仿制药相比,形成强烈的反差,彰显微球的高技术门槛。
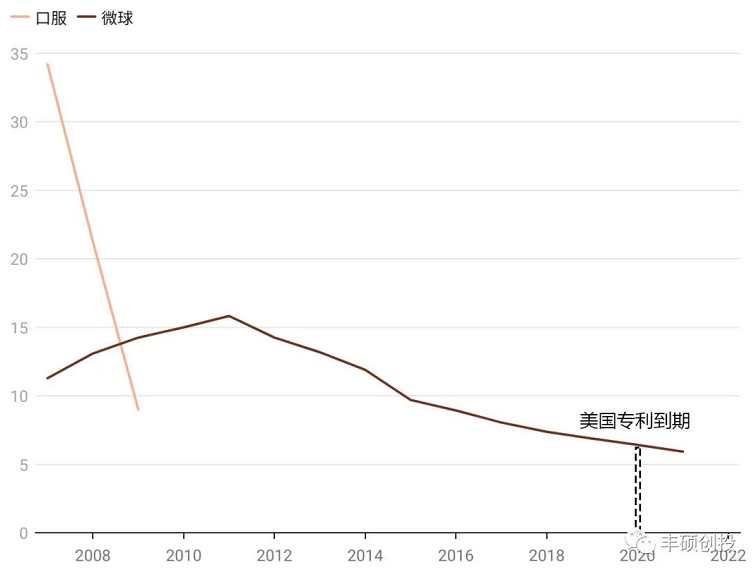
图9 利培酮历年来销售,单位亿美元(来源:强生年报,丰硕创投整理)
另一方面,indivior公司走改良型新药开发路径,根据橙皮书披露,最早申请的专利号为10010612,申请时间为2008年,当时的候选药物为rbo-7000,据clinicaltrials登记时间显示,最早于2012年进入临床试验阶段,直到2018年获得fda批准,2021年的销售额为1700万美元(同比增长21%)。perseris这款药物主要对两个地方进行了改进,从2周制剂变成了1月制剂,并且不需要推荐负荷剂量和口服补充利培酮。
花费如此大的时间和资金精力,仅仅取得目前这样的销售成绩,或许当初走高端仿制药路径会有不一样的结果,毕竟在疗效没作出革命性突破时,很难和成熟的老牌药物竞争。同时我们不能忽略了,在活性成分一样的情况下,做出pd等效比pk等效要容易的多了,这不也说明了高端制剂品种的高仿制门槛么。
长效奥氮平注射剂
奥氮平和利培酮相似,是一种非典型抗精神病药物,刚开始的剂型为每日制剂,后面开发出了长效奥氮平注射剂(1月制剂)。
从下面3张图可以看出,制造门槛低的奥氮平每日剂型,一旦专利到期,仿制药商就会蜂拥而出。
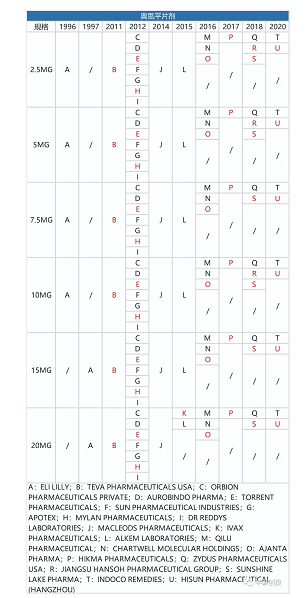
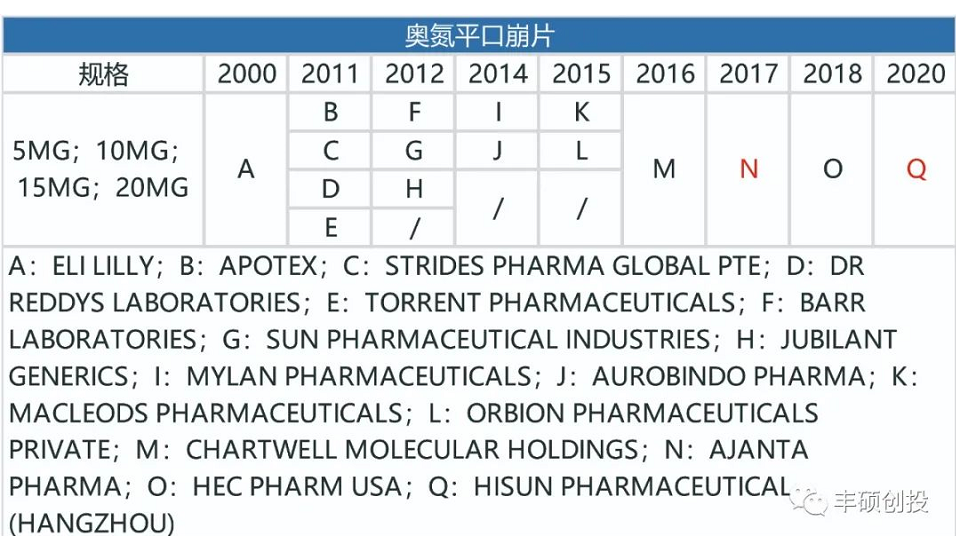
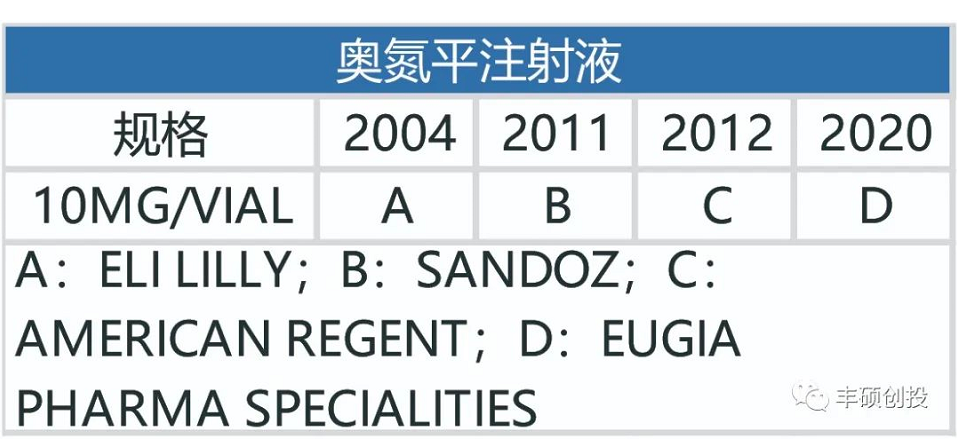
图10 fda历年来获批的奥氮平每日剂型品种(红色代表退市,来源:fda,丰硕创投整理)
长效奥氮平注射剂(1月制剂)于2009年获得美国fda批准,次年2010年整个奥氮平的品种达到历史销售峰值50.264亿美元,此时的销售贡献主要来自于奥氮平的每日制剂。之后由于奥氮平每日制剂的专利悬崖,面对上述蜂拥而来的仿制药竞品,全剂型奥氮平销售额从2011年的46.22亿美元下降到2012年的17.014亿美元,降幅达到63.19%。。
虽然礼来从未单独公布长效奥氮平注射剂的销售额,但从全剂型的销售情况来看,长效奥氮平注射剂并不能很好地完成交接棒,让销售额完成二次上涨,这里面很大原因在于长效奥氮平注射剂具有特有的罕见的注射后谵妄镇静综合征,限制其扩大使用。
但是从近年来稳定的销售额来看,且在2021年首次实现同比增长(2011年后),稳定在4~5亿美元左右,足以证明长效奥氮平注射剂的临床价值(基于十数家奥氮平每日制剂的仿制药竞品,推断此时的销售额主要来自尚无仿制药竞品的长效奥氮平注射剂),可能基于其与利培酮微球相比,不需要口服补充剂,与口服奥氮平相比,代谢方面的影响(体重增加、脂质异常、葡萄糖失调)更轻。
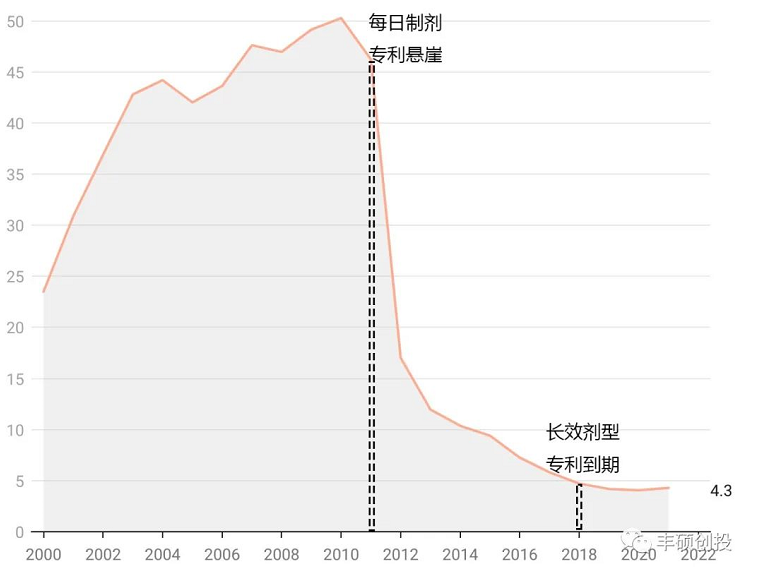
图11 奥氮平全剂型历年来销售,单位亿美元(来源:礼来年报,丰硕创投整理)
长效奥氮平注射剂的专利2018年到期,至今尚无仿制药,4~5亿美元左右的品种,只要能做出来,没有哪个厂家会拒绝,再次印证长效制剂的门槛高。
注射用亮丙瑞林微球
亮丙瑞林是天然存在的促性腺激素释放激素的合成九肽类似物,比天然激素具有更大的效力,主要用于治疗乳腺癌、前列腺癌、子宫内膜异位症和中枢性早熟。刚开始的剂型为每日注射剂,后面开发出注射用亮丙瑞林微球(1月/3月制剂)。核对fda每年的橙皮书名单,艾伯维的原研lupron每日注射剂在2011年退出市场。
注射用亮丙瑞林微球自1989年获得美国fda批准,至今一直销售了30多年,这款产品由武田开发和生产,武田负责欧亚市场商业化,艾伯维负责美国市场商业化。翻查艾伯维披露的历年来年报,2012年起的销售数据全部为注射用亮丙瑞林微球,其销售额近十年来一直保持在8亿美元左右,近两年的下降是由于全球疫情导致的原材料供应问题。在2021年,注射用亮丙瑞林微球的全球销售额大约在15亿美元左右。
同时美国市场贡献这款药的绝大多数收入,其年报也提及销售增长较为厉害的那些年份的业绩归因,归咎于需求增长和美国市场有利的价格。也只有制造工艺门槛高,杜绝了后来仿制者,让其常年来能够维持较高的定价和获得较客观的销售。
关于此品种的开发难度(资料6),2020年fda更是直接拨款5年500万美元给密歇根大学和马里兰大学,用于建立复杂高端制剂的仿制工作。该新闻提到一些产品在失去专利后,由于过于复杂而无法仿制出来,举了两个典型例子,一个就是注射用亮丙瑞林微球,另一个就是上文提及的两性霉素b脂质体(2021年已有首仿)。
回到国内,cde近年来频繁出台各种指导原则,旨在让国内企业生产出高质量的药物。在2020年6月28日,cde公开征求《gnrh激动剂用于晚期前列腺癌临床试验设计指导原则》意见的通知,里面对仿制药的要求,提到的指标可以是pk或pd,到了2020年11月26日,发布《gnrh激动剂用于晚期前列腺癌临床试验设计指导原则》的通告(2020年第45号),里面对仿制药的要求,指标确定只有pk了。在cde高质量的把控下,杜绝了国内部分尝试以开发难度更低的pd指标去开发此品种仿制药的企业。
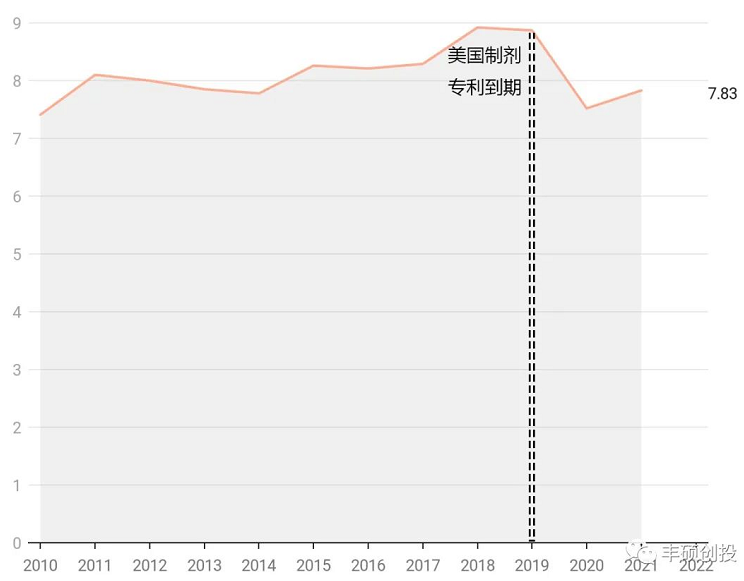
图12 亮丙瑞林历年来销售,单位亿美元(来源:艾伯维年报,丰硕创投整理)
注射用曲普瑞林微球
曲普瑞林和亮丙瑞林的作用机理相似,是一种合成十肽类似物。最早于1986年在法国获批,目前有1月制剂、3月制剂和半年制剂,原研ipsen的decapeptyl的1月制剂和3月制剂早在2010年专利到期(资料7),即便如此,近几年的销售额连年递增(除了2020年收到疫情影响),2021年仅在欧洲和新兴国家市场的销售额就达到4.596亿欧元(中国占21%即约6.7亿人民币),2022q1季度继续保持高增长,同比增长21.6%。这一切都得益于高门槛、低竞争和好品种,专利到期12年后仍没有此品种的仿制药。
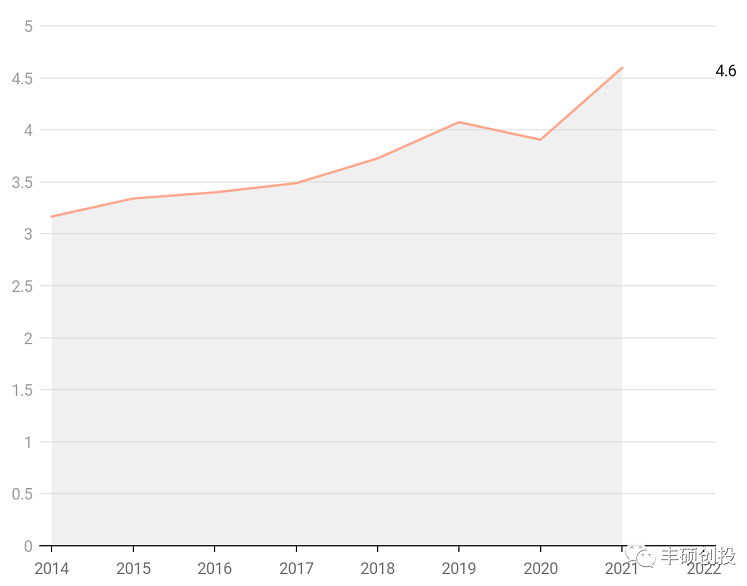
图13 曲普瑞林历年来销售,单位亿欧元(来源:ipsen年报,丰硕创投整理)
盐酸伊立替康脂质体注射液
伊立替康是喜树碱类似物,作为一种前药,在体内代谢为活性代谢物sn-38,已成为转移性crc的关键药物之一。辉瑞原研camptosar盐酸伊立替康注射液的美国专利于2008年到期,仿制药蜂拥而来,当年销售额立马从2007年的9.69亿美元将到2008年的5.63亿美元,降幅达41.90%,美国市场贡献了一半以上的销售额(资料8),从下图可以看出,意味着只要门槛低,仿制药商是不会放过4~5亿左右的品种(美国市场)。
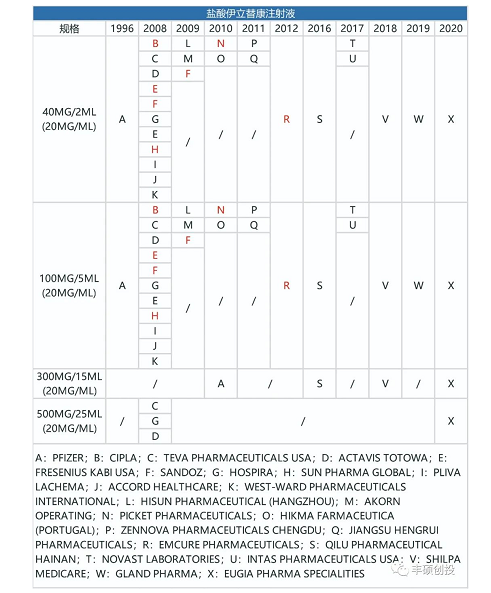
图14 fda历年来获批的伊立替康普通注射液品种(红色代表退市,来源:fda,丰硕创投整理)
基于伊立替康的快速代谢与全身暴露引起的一些急性毒性(胃肠毒性等),通过使用脂质体包裹延长其半衰期并改善药物的全身分布,挖掘伊立替康更多的临床应用价值。第一款盐酸伊立替康脂质体注射液onivyde于2015年获得美国fda批准,获批用于二线治疗转移性胰腺癌,近些年来的销售额较为平稳,于2021年在北美和欧洲市场取得1.274亿欧元的销售,2022q1销售额同比增长51.4%,取得较大的增速。目前仍在进行适应症拓展,包括肺癌、胃癌和其他实体瘤等,增量市场较为广阔,更有的分析师预测其销售峰值为15亿美元(资料9)。
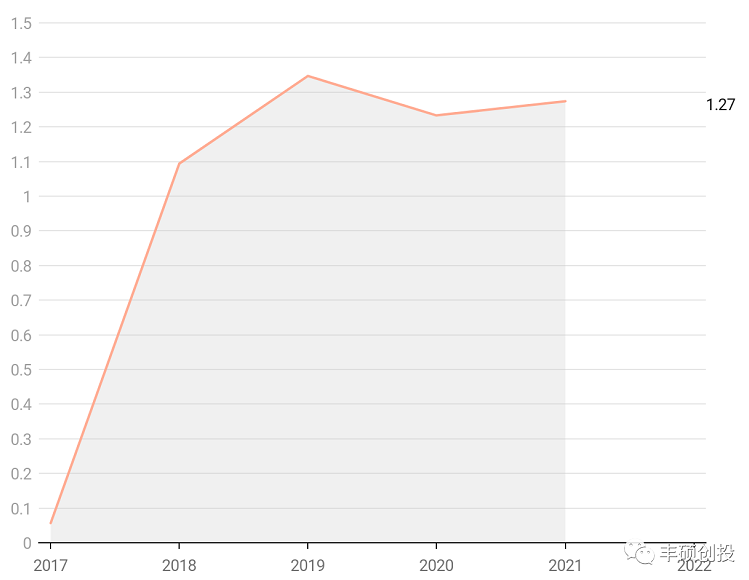
图15 伊立替康脂质体历年来销售,单位亿欧元(来源:ipsen年报,丰硕创投整理)
根据fda橙皮书披露,onivyde的美国专利最晚于2037年到期,而中国的制剂专利则在2025年到期(并没有关键的组合物专利),巨大的中美之间的专利差异,使得国内有能力的制药商,能够提前仿制出来,享受原研仍在不断扩适应症的增量市场。
棕榈酸帕利哌酮长效注射液
帕利哌酮是一种非典型抗精神病药物,是利培酮的主要代谢产品,开发路径相似,2006年美国获批每日口服制剂invega,2009年美国获批1月制剂invega sustenna,2015年美国获批3月制剂invega trinza,2021年美国获批半年制剂invega hafyera。
从下图可以看出,制造门槛低的帕利哌酮缓释片,一旦专利到期,仿制药商同样不会手下留情,短短几年内就已经出现了6家仿制药商。
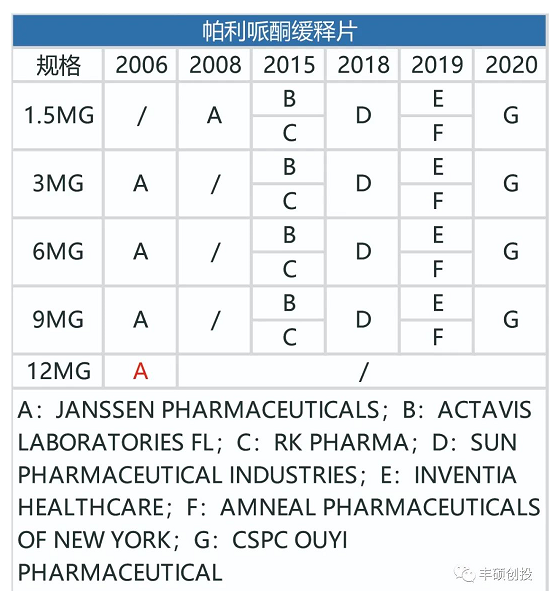
图16 fda历年来获批的帕利哌酮缓释片品种(红色代表退市,来源:fda,丰硕创投整理)
2015年两家仿制药商的出现,使得帕利哌酮片剂的销售额从2015年的5.73亿美元降至2016年的3.11亿美元,降幅达45.72%。
下图帕利哌酮长效制剂的销售情况足以说明其巨大的市场空间,2010-2014为1月制剂,2015-2020为1月制剂 3月制剂,2021为1月制剂 3月制剂 6月制剂。2022q1销售额同比增长8.6%,长效制剂销售额尚未达峰。
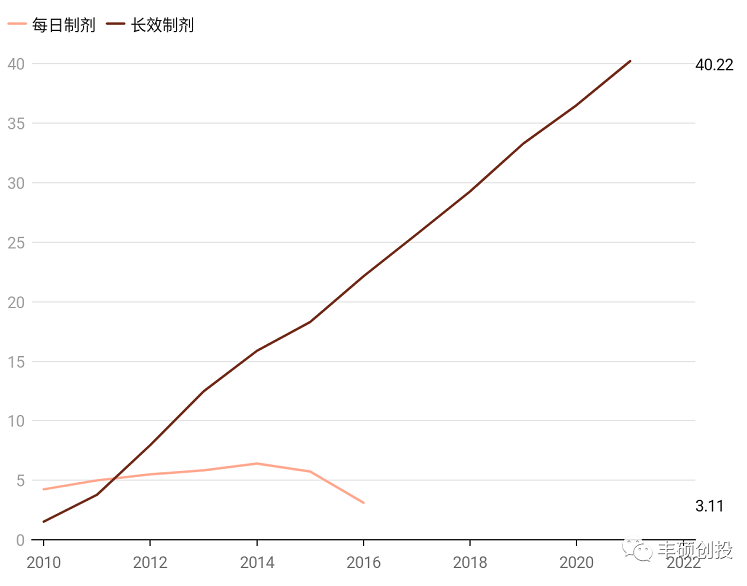
图17 帕利哌酮历年来销售,单位亿美元(来源:强生年报,丰硕创投整理)
面对如此巨大的品种,仿制药商当然不会放过,teva产品在2021年已经造出来了,奈何us9439906b2这个关于给药方案的专利要到2028年才到期,teva正与强生打官司(资料10)。而中国方面,同族专利cn101932327a被驳回,cn105560176a仍未被授权,两地的专利审查差异,让国内有实力的企业可以更早地将优质药物惠及广大患者。
布比卡因脂质体注射用混悬液
布比卡因属于酰胺类局部麻醉剂,与传统的布比卡因注射剂仅能提供术中不到7小时的麻醉作用不同,布比卡因脂质体注射用混悬液扩大了应用场景,可用于术后72小时的镇痛,显著的止痛作用能够减少成瘾性阿片类药物的使用。
pacira公司的布比卡因脂质体注射用混悬液exparel于2011年获得美国fda批准,于2021年取得5.07亿美元的销售额,2022q1销售同比增长13%,仍处于快速增长阶段。2020年(含)前仅为美国市场,之后为欧美市场。
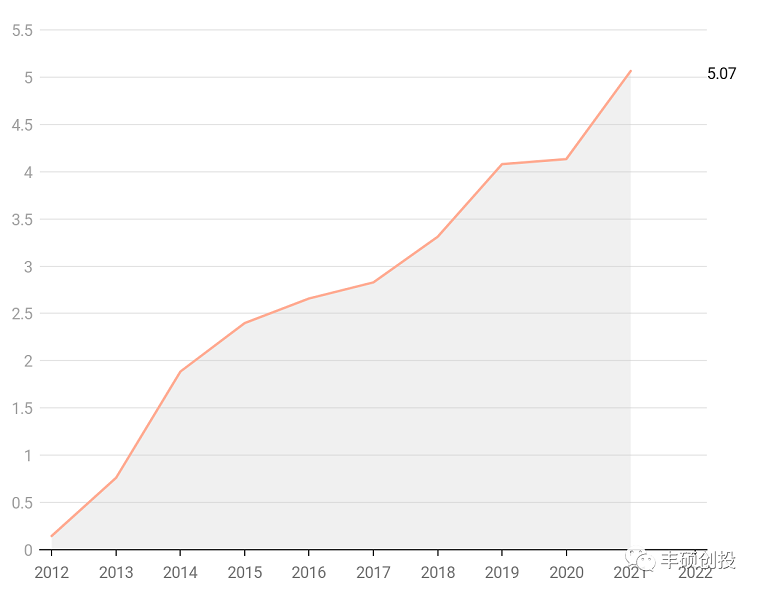
图18 exparel历年来销售,单位亿美元(来源:pacira年报,丰硕创投整理)
同样由于中美两地的专利审查差异,美国那边存在“接力式”的制造工艺专利us11033495b1,美国到期时间为2041年,evenus公司正与pacira打官司(资料11),而中国则不存在这样的同族专利,所有专利均已到期。
阿立哌唑长效注射剂
阿立哌唑是一种非典型抗精神病药物,和抗精神病药物开发路径相似,2002年美国获批每日口服片剂abilify,2013年美国获批1月制剂abilify maintena。
从下图可以看出,制造门槛低的帕利哌酮每日制剂,一旦专利到期,仿制药商一如往常地,短短几年内就充斥了整个市场。
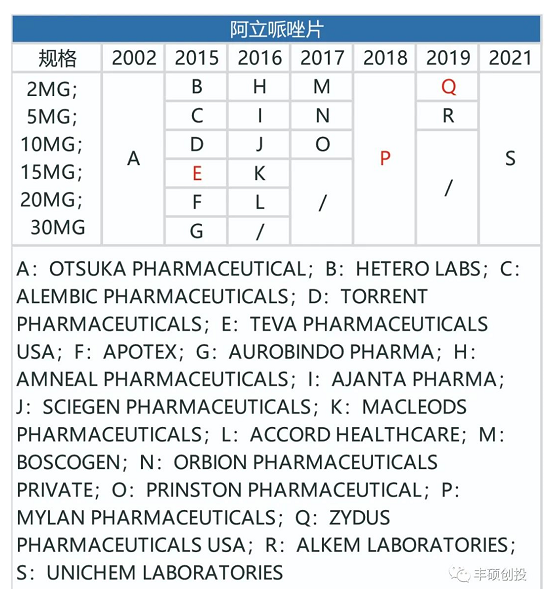
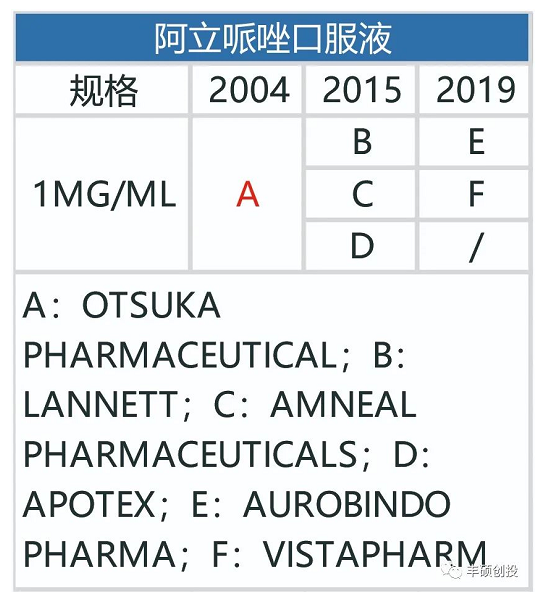
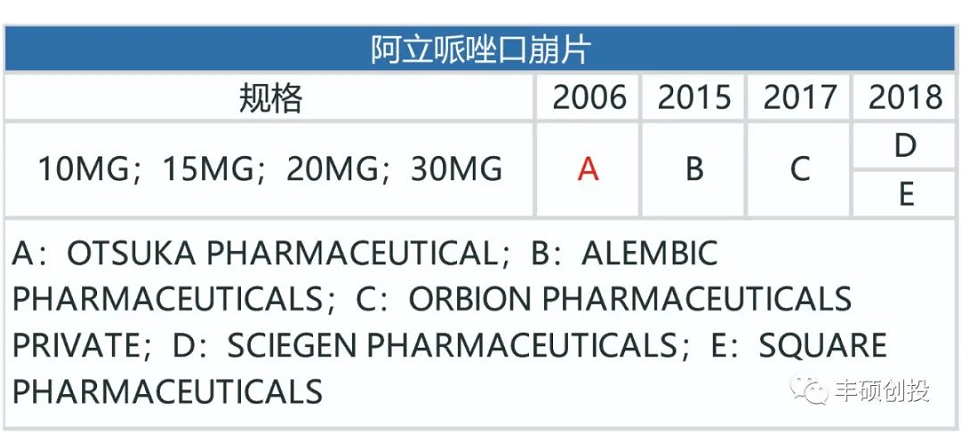
图19 fda历年来获批的阿立哌唑每日制剂品种(红色代表退市,来源:fda,丰硕创投整理)
下图的销售情况可以看出,面对每日剂型仿制药商的白热化竞争,阿立哌唑每日剂型的销售额从2014年的6542亿日元降至2015年的3475亿日元,再降至2016年的954亿日元,降幅分别为46.88%和72.55%。
此时刚获批上市没多久的阿哌利唑长效剂型迎难而上,连续多年来保持正的销售增速,2021年的销售额在10亿美元左右,同比增速为12.28%,市场主要为美国、日本和欧洲。

图20 阿立哌唑历年来销售,单位亿日元(来源:otsuka年报,丰硕创投整理)
同样由于中美之间的专利审查差异,让美国地区的仿制药商不能顺利地仿制,对其上市销售造成很大困扰。中国这边的组合物的关键专利在2024年到期,美国那边也相似,但美国那边还包括针对特定人群类似于“适应症”的专利,得到2034年到期,而中国则没有这项专利。
这项专利保护了阿立哌唑用于cyp2d6或cyp3a4酶强代谢并同时使用这两个酶抑制剂的患者。临床上阿立哌唑一般会联用其它cns药物,如cyp3a4抑制剂酮康唑,cyp2d6抑制剂奎尼丁、氟西汀或帕罗西汀,实际应用上给仿制药商造成很大的困扰。
下图是本文的一些小结。
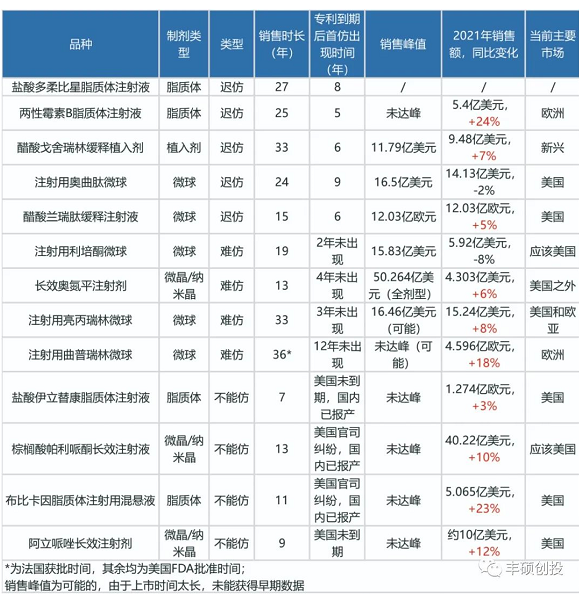
图21 高度复杂制剂本文小结(丰硕创投整理)
至此,高度复杂制剂的高门槛和常年的高利润空间属性已经阐述地十分清楚了。时至今日,国内某些创新药品种的利润空间已经比不上某些竞争空间相对宽松的生物类似药了,若仍是一味地“贴标签”式地投资,至少在国内医药投资上,最后免不了一地鸡毛。因为中外之间的未满足临床需求的差距,导致未来很长一段时间里,主要矛盾依旧是填补这段临床需求的差距,只是走的路径不太一样,名头响亮的、故事动听的且容易募资的,叫做“创新药”,带有“仿制”标签的高端复杂制剂却一直遭受普通制剂仿制药同样的待遇。要知道,这些高端复杂制剂的仿制药,连国外都存在巨大的未满足临床需求,而目前国内这些“创新药”是否能满足国外的未满足临床需求呢?
参考文献