引言
大多数疫苗都需要进行多次注射,然后才能认为接受者已完全接种疫苗。然而麻省理工学院的研究人员却有着不同的思路,利用聚合物层冲压组装技术开发了可以调整以在不同时间点传递有效载荷的微粒,这些微粒可用于制造“自我增强”疫苗,甚至扩展到其他疾病药物领域。
这项技术的研究最早可追溯到2017年,当时,研究人员利用plga(聚乳酸-羟基乙酸共聚物, 生物相容性好,用来做可吸收手术缝线的就是它)构造了核壳微粒——一种形似咖啡杯的药物封装结构。

这些微粒在释放时间点、形态以及与生物制剂和亲水性小分子的相容性方面的独特可调性,这使得研究人员可以设计出只需接种一次的疫苗,然后在未来的特定时间点“自我增强”。颗粒可以留在皮肤下,直到疫苗释放然后分解,就像可吸收缝线一样。
递送系统的药代动力学性质
研究发现,通过调控plga的成分调控药物成分的释放,完全可以实现一次注射,多批释放。比如首次注射后立即释放一部分药物,利用不同的plga聚合物将药物分别在第二周或者第6个月释放一次。
而且不同于传统的缓释/控释制剂(微球,微丸等)需要严格控制颗粒的大小(其颗粒大小对于药物释放时间有重要作用),研究所用plga颗粒是基于聚合物组成的差异和聚合物末端连接的化学基团来调控其药物的释放,这使得颗粒的大小和形状对于药物的释放几乎没有影响。
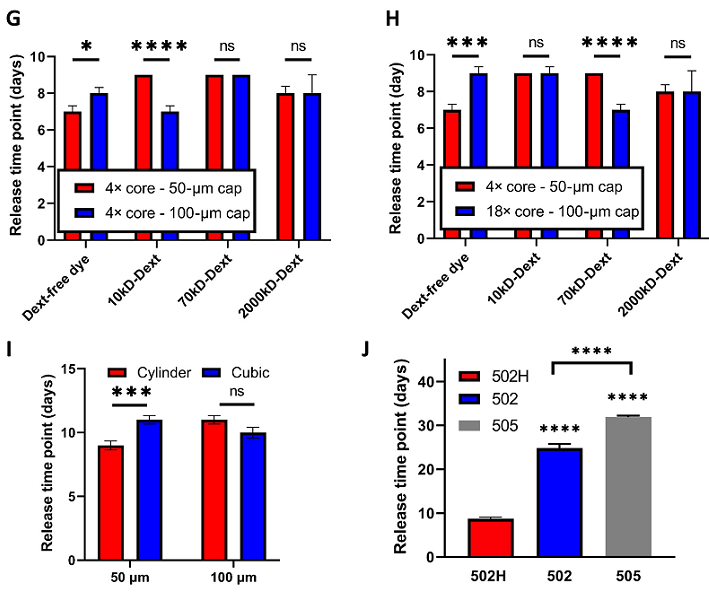
( g )帽壁厚度、( h )芯尺寸、( i )形状、( j )帽mw和端基对可生物降解核壳微粒释放动力学的影响
但这种聚合物材料也有一些亟待解决的问题,当水分解 plga 聚合物时,副产物包括乳酸和乙醇酸,使整体环境更加酸性,这会损坏颗粒中对ph敏感的蛋白质/核酸药物。研究人员现在正在研究抵消这种酸度增加的方法,希望能提高颗粒内携带的有效载荷的稳定性。
[1]experimental and computational understanding of pulsatile release mechanism from biodegradable core-shell microparticles
[2] fabrication of fillable microparticles and other complex 3d microstructures